국내 인·허가
왼쪽메뉴
국내 인·허가
본문컨텐츠
신청자용 가이드라인
STEP 1. 위해성심사 대상 확인
해당하는 LMO 위해성심사 절차 및 정보를 확인할 수 있는 문항은 총 5개로 구성되어 있습니다. 각 문항별 해당하는 부분에 체크하시기 바랍니다.
01. 당신은 LMO개발자입니까?
한국바이오안전성정보센터(KBCH)에 문의하세요.
홈페이지 : https://www.biosafety.or.kr 대표이메일 : ghmoon@kribb.re.kr
02. 당신의 LMO는 해외에서 승인을 받았거나 승인을 받을 예정입니까?
한국바이오안전성정보센터(KBCH)에 문의하세요.
홈페이지 : https://www.biosafety.or.kr 대표이메일 : ghmoon@kribb.re.kr
03. 당신의 LMO는 위해성 심사 대상입니까?
신규 산업용 LMO를 수입 ㆍ생산 ㆍ이용하려는 자는 수입승인, 생산승인 및 유전자변형미생물의 이용 승인을 받기 전까지 산업통상자원부에서 위해성심사를 받아야 합니다.(LMO 법 제7조의2제1항 본문)
※ 신규 산업용 LMO를 생산하려는 자 또는 이용하려는 자가 수입 시에 위해성심사를 받은 신규 산업용 LMO를 생산하거나 이용하는 경우에는 위해성심사를 받지 않아도 됩니다.(LMO법 제7조의2제1항 단서)
※ [별표10-1] 제2항에서 규정하고 있는 미생물의 정의에 따라 제1위험군 미생물을 셀프-클로닝하여 밀폐이용하는 경우에는 위해성심사의 대상이 되지 않습니다. 그러나 이 경우 반드시 해당기관에 심사제외대상 여부를 확인받아야 합니다.(LMO 통합고시 10-1제2항)
① 신규 산업용 LMO를 개발한 자가 해당 산업용 LMO를 수입, 생산 또는 이용하기 전에 위해성심사를 받았거나 ② 해당 산업용 LMO의 수입 ㆍ생산 또는 이용목적이 ①의 위해성심사의 이용목적과 동일한 경우에는 위해성심사를 면제받을 수 있습니다. (LMO법 제7조의제2항 및 LMO법 시행령 제4조의3제2항)
04.LMO를 이용하고자 하는 용도는 무엇입니까?
산업용 유전자변형생물체”라 함은 시험 ㆍ연구용 유전자변형생물체, 농림축산업용 유전자변형생물체, 보건의료용 유전자변형생물체, 환경정화용 유전자변형생물체, 또는 해양용 ㆍ수산용 유전자변형생물체를 제외한 섬유 ㆍ기계 ㆍ화학 ㆍ전자 ㆍ에너지 ㆍ자원 등의 산업분야에 이용되는 유전자변형생물체를 말한다. (LMO법 통합고시 제1-2조 5항)
한국바이오안전성정보센터(KBCH)에 문의하세요.
홈페이지 : https://www.biosafety.or.kr 대표이메일 : ghmoon@kribb.re.kr
05. 당신의 LMO는 생산공정1등급시설에서 이용됩니까?
"생산공정이용"이라 함은 생산공정 중에 유전자변형생물체가 대기, 물, 토양 등과 같은 외부 환경으로 확산되지 못하도록 시설, 설비 또는 그 밖의 구조물 내에서 유전자변형생물체를 이용하는 것을 말한다. (LMO법 통합고시 제1-2조 26항)
생산공정 중에 산업용 LMO를 이용하는 시설 중에서 안전관리 등급이 1등급 및 2등급에 해당하는 생산공정이용시설을 설치 ㆍ운영하려면 산업통상자원부에 신고해야 합니다. (LMO법 제22조의3제1항 및 LMO통합고시 제4-15조제2항)
생산공정이용시설의 안전관리등급 분류에 따른 신고 대상은 다음과 같습니다. (LMO법 제22조의3제1항 및 LMO법 시행령 제23조의8제1항, 별표2)

용도별 LMO 주관부처
한국바이오안전성정보센터(KBCH)에 문의하세요.
홈페이지 : https://www.biosafety.or.kr 대표이메일 : ghmoon@kribb.re.kr
- 위해성심사 신청서(LMO법 시행규칙 별지 4-1), 위해성평가자료(통합고시 별표 4-3)작성
- 수수료없음
- 바이오안전성정보센터(이메일주소 or 연락처)로 접수
- 위해성심사 신청서, 위해성심사 자료 1부와 해당 전자문서 20부 제출
- 심사기간 90일
- 산업통상자원부 주관으로 진행되며, 관계부처에 협의심사 요청
- 인체위해성심사는 보건복지부 질병관리청에 협의요청(신청일로부터 60일이내)
- 환경위해성심사는 환경부 국립생태원, 농림축산식품부 농촌진흥청, 해양수산부 화학수산과학원에 협의요청(신청일로부터 30일이내)
- 인체위해성심사는 보건복지부 질병관리청에서 진행
- 환경위해성심사는 환경부 국립생태원, 농림축산식품부 농촌진흥청, 해양수산부 화학수산과학원에서 진행
- 산업통상자원부에서 위해성심사 결과통보서 발급하여 통보(통합고시 별지 제4-2호)
- 30일 이상 한국바이오안전성정보센터 홈페이지 (http://www.biosafety.or.kr) 개시
- 정보공개 범위 : 위해성심사 신청인, 위해성심사 목적 및 최종용도, 위해성심사 결과, 산업용 LMO의 개발자, 산업용 LMO의 명칭, 특성 등
- 위해성심사 신청서(LMO법 시행규칙 별지 제1호), 위해성평가자료(통합고시 별표 10-1)작성
- 수수료 400만원
- * 대학, 산업대학, 전문대학 및 기술대학, 정부출연연구기관, 국공립 연구기관, 특정연구기관, 한국보건산업진흥원 등은 수수료를 면제받을 수 있음
- 바이오안전성정보센터(이메일주소 or 연락처)로 접수
- 위해성평가자료는 위해성평가자료제출표에 기재된 순서에 따라 자료별 색인번호 및 쪽을 표시하고, 평가자료 1부와 전자문서 20부 제출
- 심사기간 270일
- 산업통상자원부 주관으로 진행되며, 관계부처에 협의심사 요청
- 인체위해성심사는 보건복지부 질병관리청에 협의요청(신청일로부터 60일이내)
- 환경위해성심사는 환경부 국립생태원, 농림축산식품부 농촌진흥청, 해양수산부 화학수산과학원에 협의요청(신청일로부터 30일이내)
- 인체위해성심사는 보건복지부 질병관리청에서 진행
- 환경위해성심사는 환경부 국립생태원, 농림축산식품부 농촌진흥청, 해양수산부 화학수산과학원에서 진행
- 산업통상자원부에 협의심사 요청받은 날로부터 210일 이내 통보
- 산업통상자원부에서 위해성심사 결과통보서, 결과보고서 작성
- 30일 이상 한국바이오안전성정보센터 홈페이지 (http://www.biosafety.or.kr) 개시
당신의 LMO에 해당하는 위해성심사 자료제출 범위입니다. 원활한 위해성심사 절차가 진행될 수 있도록 참고하여 주십시오.
| 가. 생산공정이용의 배경 및 목적 1) 심사를 신청하는 LMM의 명칭, 생산공정이용의 배경과 신규 도입유전자 산물의 사용 목적, 산업적 필요성, 장점 등에 대해 기술 |
|
| 나. 주요 용도 1) 생산공정에서 LMM의 주요 용도 및 역할에 대해 기술 |
|
다. 사용이 승인된 국가 및 승인용도
|
| * 다음 각 항목에 대해 문헌 정보를 근거로 제시하고 관련 사항을 기술 | |
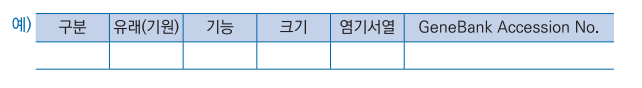
가. 명칭, 유래 및 분류학적 특성
|
|
나. 생산공정이용시설에서 이용하고자 하는 유전자변형미생물과 유사한 용도의 유전자변형미생물이 숙주로 이용된 사례
|
|
다. 숙주 및 근연종에서의 독소 생산성, 알레르기 유발성 및 기타 유해 생리활성물질 생산성 여부
|
|
라. 병원성 존재 여부 및 알려진 병원체와의 관련성
|
|
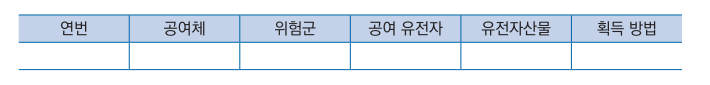
3. 공여체에 관한 자료
가. 명칭, 유래 및 분류학적 특성
|
|
나. 생산공정이용시설에서 이용하고자 하는 유전자변형미생물과 유사한 용도의 유전자변형미생물이 공여체로 이용된 사례
|
|
다. 공여체 및 근연종에서의 독소 생산성, 알레르기 유발성 및 기타 유해 생리활성물질 생산성 여부
|
|
라. 병원성 존재 여부 및 알려진 병원체와의 관련성
|
4. 유전자변형 특성에 관한 자료
가. 벡터에 관한 자료
|
|
나. 도입유전자에 관한 자료
|
|
다. 유전자변형에 사용된 현대생명공학기술 상세 실험방법
|
5. 유전자변형미생물에 관한 자료
| ※ 중복된 내용 작성 지양: 이미 기술된 내용은 참조가 필요한 쪽과 내용 요약으로 대체 가능 | |
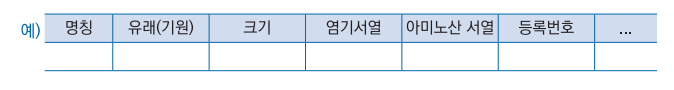
가. 명칭
|
|
나. 도입유전자에 의하여 부여된 특성
|
|
다. 숙주 또는 근연종과의 생물학적 특성의 차이
|
|
라. 병원성, 독소 생산성, 알레르기 유발성 및 기타 유해 생리활성물질 생산가능성
|
|
마. 유전자변형미생물 내 도입유전자의 위치 및 복제 수
|
|
바. 유전자변형에 사용된 벡터의 특성 및 존재 여부
|
|
사. 유전자변형미생물 및 도입유전자의 검출 및 확인 방법
|
|
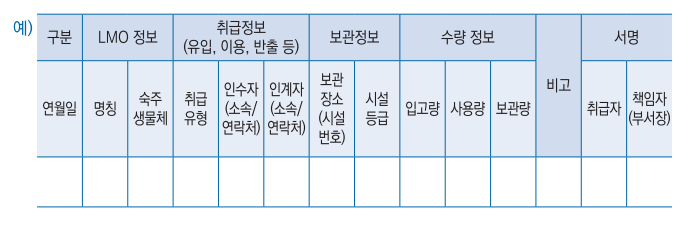
6. 유전자변형미생물의 이용 안전관리에 관한 자료
| ※ 생산시설이 확보되지 않은 경우, 필요한 실험결과들은 제출계획(시한 및 내용 포함)을 제시한 후 시설이용 승인 후 제출할 수 있음: 6-가-2)-가) 검출방법 중, “공정별 LMM 검출 또는 부정시험 결과”, 6-라-1 보관 중 “LMM 반출·입, 사용 이력 관리 등 추적 이력 기록물”, 별도 장소에 보관된 Cell Bank/Master stock 이송의 “관련 사진 자료”, 6-라-3)-가) LMM 불활성화(사멸화) 방법 중 “LMM 불활성화(사멸화 공정) 확인 자료” 등 | |
가. 생산공정 중 이용할 유전자변형미생물의 이용 방법 및 형태에 관한 설명자료
|
|
나. 생산공정이용시설 설치·운영에 관한 설명자료
|
|
다. 생산공정이용의 안전관리수칙 및 응급조치 사항
|
|
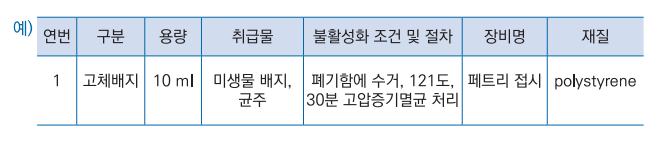
라. 유전자변형미생물 보관·표시방법, 불활성화 및 폐기 방법
|
|
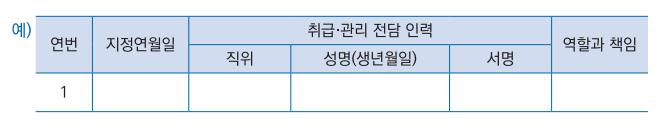
마. 관련 전문인력 현황
|
|